
- Badania laboratoryjne
-
by Monika Cyprian
Nieswoiste choroby zapalne jelit (NChZJ), np. choroba Leśniowskiego-Crohna i wrzodziejące zapalenie jelita grubego (łac. colitis ulcerosa), to schorzenia o podłożu autoimmunizacyjnym, przebiegające z okresami zaostrzeń i remisji. Wrzodziejące zapalenie jelita grubego charakteryzuje się zmianami zapalnymi w obrębie błony śluzowej jelita grubego, natomiast w przypadku choroby Leśniowskiego-Crohna ziarniniakowe zmiany występują najczęściej w jelitach, jednak mogą pojawiać się też w innych odcinkach przewodu pokarmowego.
Nieswoiste choroby zapalne jelit – objawy
Objawy choroby Crohna i wrzodziejącego zapalenia jelita grubego mogą być zbliżone, u pacjentów stwierdza się:
- bóle brzucha,
- wzdęcia,
- biegunki,
- zaparcia,
- osłabienie,
- chudnięcie,
- krew w stolcu.
Cechy wspólne nieswoistych chorób zapalnych jelit to:
- początkowo zbliżony obraz kliniczny i podwyższone stężenie kalprotektyny w kale w fazie aktywnej choroby,
- większe ryzyko nowotworów przewodu pokarmowego, głównie jelit,
- młody wiek w momencie zachorowania (szczyt zachorowań 20−40 lat) [1, 2, 3, 4].
Sprawdź czym charakteryzuje się:
Nieswoiste choroby zapalne jelit – przyczyny
Nieswoiste choroby zapalne jelit charakteryzują się przewlekłym stanem zapalnym w przewodzie pokarmowym, a także w tkankach limfatycznych związanych z jelitem – GALT (ang. gut-associated lymphoid tissue). Niestety przyczyna tych schorzeń nie jest do końca poznana. Istnieją doniesienia naukowe o czynnikach immunologicznych, genetycznych i środowiskowych, które wpływają na rozwój i przebieg NChZJ [1, 2, 3]. Czynniki środowiskowe związane ze stylem życia są niezbędną zmienną przyczyniającą się do rozwoju choroby.
Świadczy o tym to, że część osób z predyspozycją genetyczną do choroby nie rozwija schorzenia. Tę teorię potwierdza również wzrost zachorowań na choroby autoimmunizacyjne notowany w krajach rozwiniętych. Jednym z głównych czynników środowiskowych branych pod uwagę w rozwoju nieswoistych chorób zapalnych jelit jest mikrobiota jelitowa.
Mikrobiota a nieswoiste choroby zapalne jelit
Mikrobiota jelitowa jest istotnym czynnikiem nasilającym stan zapalny i rozwój zmian śluzówkowych w nieswoistym zapaleniu jelit. Niektóre drobnoustroje mogą zaostrzyć stan zapalny, ale inne go łagodzą.
Dysbioza jelitowa, czyli zaburzenia liczby bakterii i zmniejszona różnorodność mikrobioty jelitowej, jest typowa dla mikrobioty pacjentów z NChZJ [5].
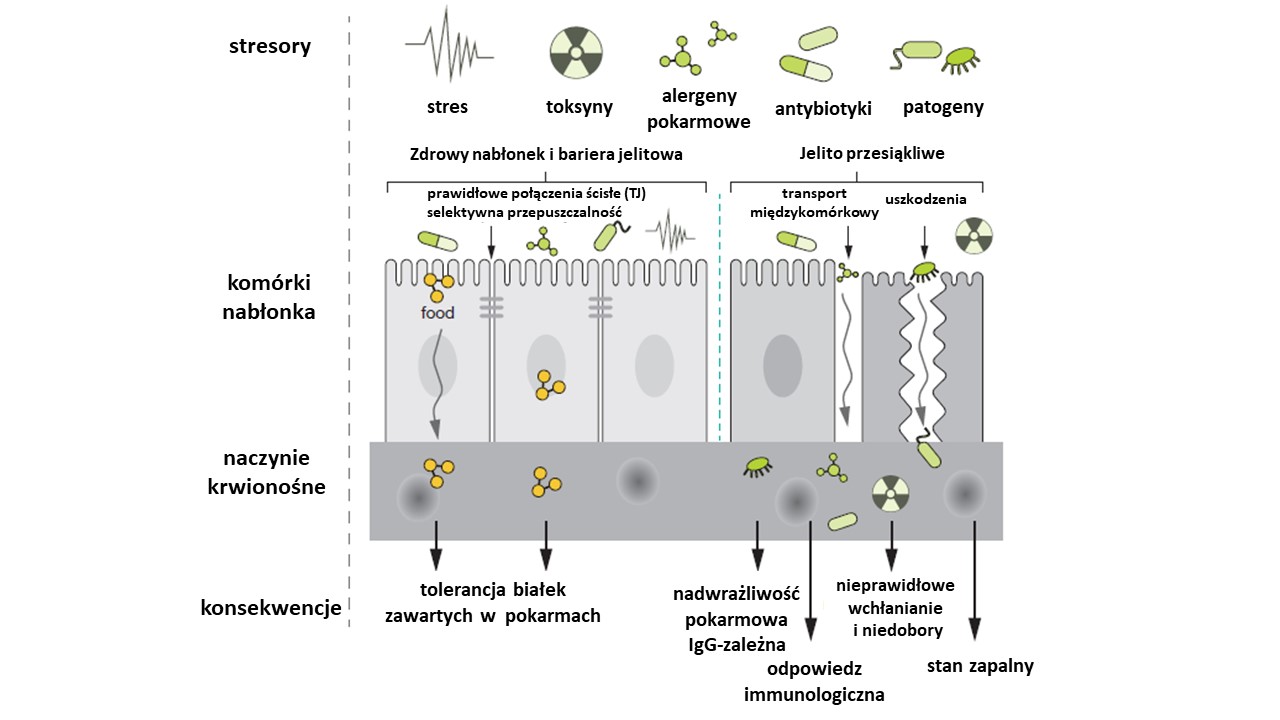
Rycina 1. Bariera jelitowa – prawidłowa a rozszczelniona.
Niestety przy zaburzeniach mikrobioty jelitowej i funkcjonowania bariery jelitowej, którą stwierdza się w przypadku NChZJ, może dojść do zwiększenia przesiąkliwości jelitowej i rozwoju nadwrażliwości IgG-zależnych. Przez barierę jelitową przedostają się nie do końca strawione białka pokarmowe, które mogą wywołać aktywację układu immunologicznego. Dochodzi wówczas do nadmiernej produkcji przeciwciał IgG względem określonych pokarmów. Prowadzi to w konsekwencji do powstawania stanu zapalnego o niskim nasileniu w organizmie i wzmożenia objawów.

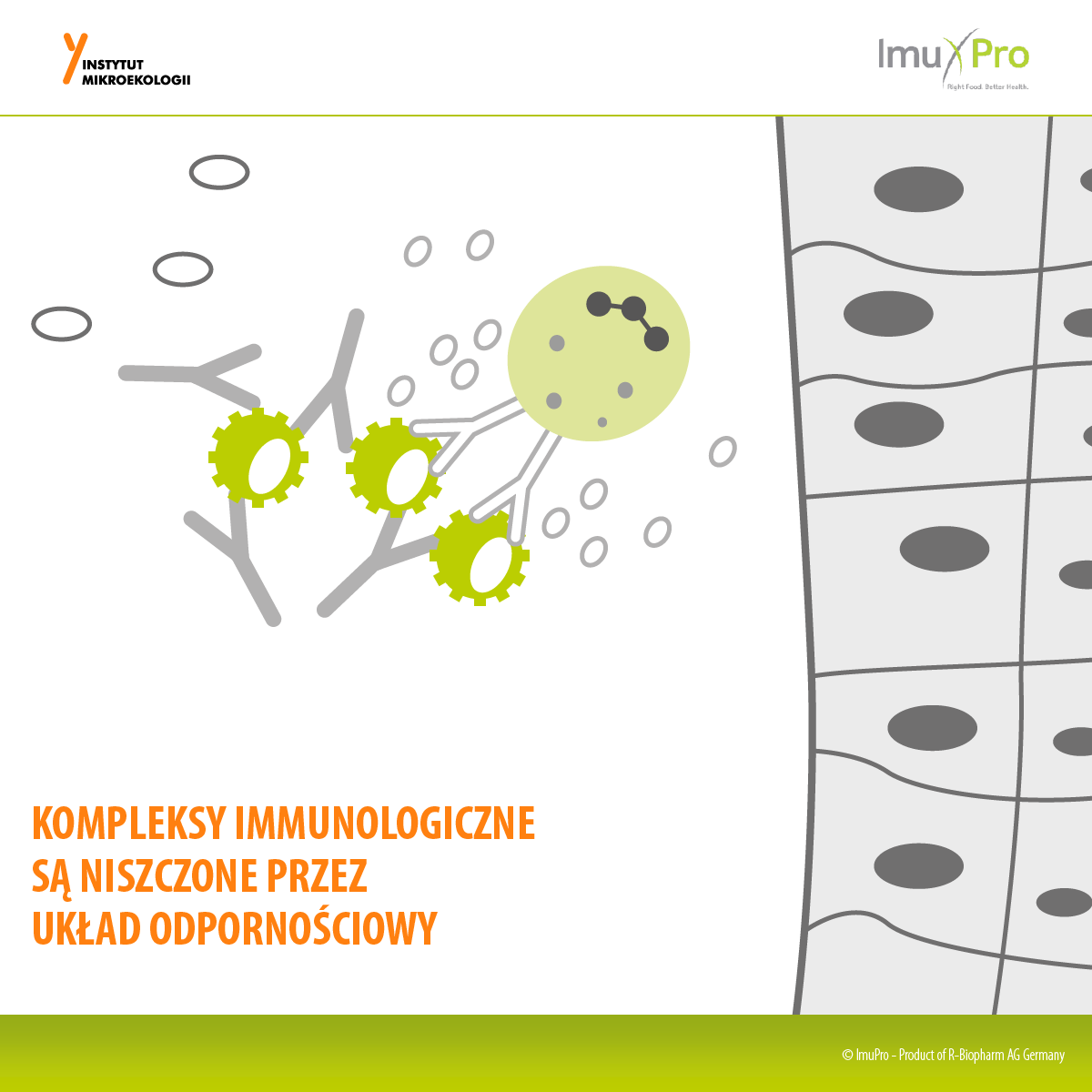

Rycina 2. Schemat powstawania nadwrażliwości pokarmowych.
Podwyższony poziom przeciwciał IgG powoduje, że dany pokarm może wywoływać i/lub nasilać dolegliwości żołądkowo-jelitowe. Diagnostyka poziomu przeciwciał IgG swoistych dla pokarmów, wykonywana np. w badaniu ImuPro i wdrożenie indywidualnych zaleceń dietetycznych na podstawie wyniku badania pozwala więc obniżyć stan zapalny i złagodzić dolegliwości.
Leczenie i dieta w nieswoistych chorobach zapalnych jelit
Leczenie w nieswoistych chorobach zapalnych jelit najczęściej sprowadza się do łagodzenia objawów, a nie przyczyny. Odpowiednie dobranie leków i dawek zawsze zaleca lekarz. Najlepsze efekty daje połączenie leczenia standardowego ze wsparciem indywidualnie dobranej diety oraz probiotykoterapii. Zindywidualizowane wsparcie mikrobioty jelitowej i jelit jest możliwe dzięki celowanej probiotykoterapii i zaleceniom prebiotycznym opracowanym na podstawie wyniku badania mikrobioty KyberKompakt Pro. Badanie wykonywane jest z kału i sprawdza liczbę:
- bakterii ochronnych,
- bakterii immunostymulujących,
- bakterii potencjalnie patogennych – proteolitycznych
- bakterii odżywiających nabłonek jelitowych,
- a także obejmuję analizę ilościową i jakościową grzybów pleśniowych i drożdżopodobnych.
Bakterie ochronne i odżywiające nabłonek jelitowy np. Faecalibacterum prauznitzi mogą mieć ochronny i przeciwzapalny wpływ na pacjentów z NChZJ [5]. Badania wykazały, że pacjenci z chorobą Leśniowskiego-Crohna mają obniżoną liczbę bakterii Faecalibacterum prauznitzi i produkowanego przez tą bakterię przeciwzapalnego kwasu masłowego [6, 7].
Nadwrażliwości pokarmowe a dieta w chorobach zapalnych jelit
Istnieją badania naukowe potwierdzające korzyści związane z eliminacją pokarmów, w stosunku do których stwierdzono podwyższony poziom przeciwciał IgG w badaniu ImuPro.
- Berntz i wsp. przeprowadzili podwójne zaślepione badanie u pacjentów z chorobą Leśniowskiego-Crohna i stwierdzili, że dieta na podstawie wyniku ImuPro istotnie redukuje częstość wypróżnień i objawy brzuszne oraz poprawia ogólną jakość życia pacjentów [8].
- Badania nad markerami stanu zapalnego u pacjentów chorych na chorobę Leśniowskiego-Crohna, wykazały, że prowokacja pokarmami, w stosunku do których stwierdzono podwyższony poziom przeciwciał IgG w badaniu ImuPro, nasilała stan zapalny, pogarszając objawy choroby. Dieteta oparta na wyniku badania IgG mogże wspomagać leczenie i poprawiać jakość życia pacjentów z chorobą Leśniowskiego-Crohna [9].
- W innym badaniu, wykonanym wśród pacjentów ze wrzodziejącym zapaleniem jelita grubego stwierdzono, że eliminacja pokarmów na podstawie badania nadwrażliwości IgG-zależnych podniosła jakość życia pacjentów [10].
O d lat do leczenia moich pacjentów podchodzę kompleksowo, uzupełniając standardowe leczenie o nowoczesną diagnostykę mikrobioty jelitowej, badania nadwrażliwości pokarmowych (ImuPro) i markerów stanu jelit np. kalprotektyny. Po wprowadzeniu diety eliminacyjnej na bazie ImuPro oraz terapii mikrobiologicznej udaje się wyciszyć przewlekły stan zapalny, znacznie zmniejszyć dolegliwości pacjentów z NchZJ i poprawić jakość ich życia. Cieszę się, że badania z różnych krajów potwierdzają moje doświadczenia. Dr n.med. Mirosława Gałęcka – lekarz, specjalista chorób wewnętrznych
d lat do leczenia moich pacjentów podchodzę kompleksowo, uzupełniając standardowe leczenie o nowoczesną diagnostykę mikrobioty jelitowej, badania nadwrażliwości pokarmowych (ImuPro) i markerów stanu jelit np. kalprotektyny. Po wprowadzeniu diety eliminacyjnej na bazie ImuPro oraz terapii mikrobiologicznej udaje się wyciszyć przewlekły stan zapalny, znacznie zmniejszyć dolegliwości pacjentów z NchZJ i poprawić jakość ich życia. Cieszę się, że badania z różnych krajów potwierdzają moje doświadczenia. Dr n.med. Mirosława Gałęcka – lekarz, specjalista chorób wewnętrznych
Poznaj składniki badane w poszczególnych panelach ImuPro
Źródła
- Bartnik W. Wytyczne postępowania w nieswoistych chorobach zapalnych jelit. Przegląd Gastroenterolo-giczny 2007; 2: 215−229.2.
- Langholz E. Current trends in inflammatory bowel disease: the natural history. Therap. Adv. Gastroenterol. 2010; 3: 77−86.3.
- Fiocchi C. Inflammatory bowel disease: etiology and pathogenesis. Gastroenterology 1998; 115: 182−205.
- Andrzejewska, M., Dereziński, P., Kokot, Z. J., & Grzymisławski, M. Metabolomika i proteomika w diagnostyce nieswoistych chorób zapalnych jelit. In Forum Zaburzeń Metabolicznych, 2016, 7(4):145-151.
- Manichanh, C., Borruel, N., Casellas, F., & Guarner, F. (2012). The gut microbiota in IBD. Nature reviews Gastroenterology & hepatology, 9(10), 599.
- Cao, Y., Shen, J., & Ran, Z. H. (2014). Association between Faecalibacterium prausnitzii reduction and inflammatory bowel disease: a meta-analysis and systematic review of the literature. Gastroenterology research and practice, 2014.
- Gałęcka M. et al. Faecalibacterium prausnitzii and Crohn’s Disease–is There any Connection?. Polish journal of microbiology 2013: 62.1 91-95.
- Bentz, S., Hausmann, M., Piberger, H., Kellermeier, S., Paul, S., Held, L., … & Rogler, G. (2010). Clinical relevance of IgG antibodies against food antigens in Crohn’s disease: a double-blind cross-over diet intervention study. Digestion, 81(4), 252-264.
- Uzunısmaıl, H., Cengız, M., Uzun, H., Ozbakir, F., Göksel, S., Demırdağ, F., … & Balci, H. (2012). The effects of provocation by foods with raised IgG antibodies and additives on the course of Crohn’s disease: a pilot study. The Turkish journal of of Gastroenterology, 23(1), 19-27.
- Jian L, Anqi H, Gang L, Litian W, Yanyan X, Mengdi W, Tong L. 2018. Food exclusion based on IgG antibodies alleviates symptoms in ulcerative colitis: A Prospective Study. Inflamm. Bowel Dis., 24: 1918–1925.
